18/07/2025
Ce que la crise des PFAS nous apprend
Robert Barouki, université Paris Cité, Inserm, Paris, France
LES PFAS
Les per- et polyfluoroalkyles (PFAS) sont des substances très utilisées dans l’industrie et sont présents dans de nombreux articles de la vie courante. L’ARS Rhône-Alpes a bien résumé leurs propriétés et leurs multiples applications (https://www.auvergne-rhone-alpes.ars.sante.fr/pfas-ce-quil-faut-savoir). Il existe des milliers de PFAS, même si pour le moment une trentaine est très utilisée. Leurs propriétés chimiques sont uniques avec une extrémité hydrophile et une chaîne carbonée plus ou moins longue aux propriétés hydrophobes. La structure des 12 000 PFAS est ainsi constituée d’une chaîne carbonée d’au moins 2 carbones avec des groupes fonctionnels (carboxylates : PFCA ; sulfonates : PFSA) leur conférant à la fois des propriétés hydrophobes et hydrophiles (Lu et coll, 2020 ; Langenbach et coll, 2021 ; Cordner et coll, 2021 ; Blake et coll, 2020). Les acides perfluoroalkyles (PFAA) linéaires « anciens » comprennent des composés utilisés de longue date (p. ex. acide perfluorooctane sulfonique, PFOS et acide perfluorooctanoïque, PFOA), tandis que les PFAS émergents font référence aux PFAA courts ou ultra-courts (avec 4-7 ou 2-3 carbones), ramifiés ou non, ainsi que des isomères dans le but de produire des alternatives plus sûres (Coperchini et al, 2020 ; Zheng et al, 2023). LES
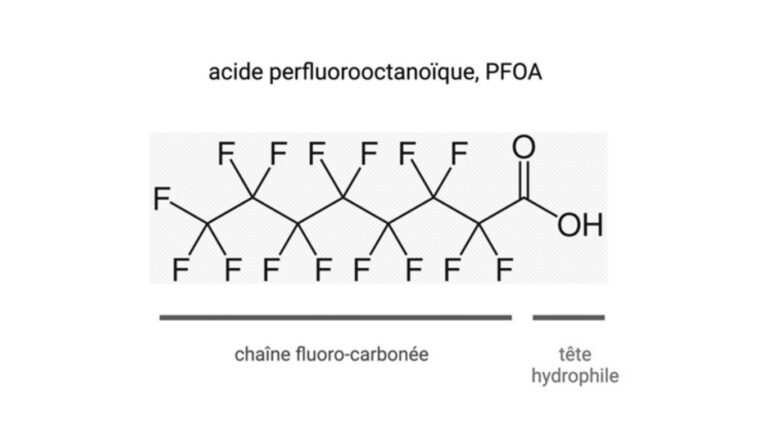
Figure 1 : formule développée du PFOA montrant une extrémité hydrophile et une chaîne fluoro-carbonée.
Ces substances comprennent plusieurs liaisons entre un carbone et un fluor. Il est bien connu en chimie que les liaisons entre un carbone et un halogène sont très solides et, en particulier, la liaison entre un carbone et un fluor (C-F) est parmi les plus stables. Les voies biologiques de métabolisations des xénobiotiques sont peu efficaces pour modifier les composés chimiques contenant ces liaisons C-F. En raison de ces liaisons, les PFAS présentent une résistance élevée à la dégradation et des propriétés thermiques et antiadhésives (Blake et coll, 2020) ; par conséquent, de nombreux PFAS ne sont pas métabolisés et s’accumulent dans les tissus humains (Pérez et al, 2013). Les PFAS sont également persistants dans l’environnement et facilement transportés loin de leurs sources d’émission.
En raison de ces propriétés, les PFAS sont des polluants organiques persistants (POP), dont trois sont contrôlés et/ou réglementés au niveau international depuis 2009 par la Stockholm Convention https://www.pops.int/(; Blake et coll, 2020 ; Kahn et al, 2020). Ces propriétés chimiques autorisent des applications très nombreuses, et ainsi on les retrouve dans les ustensiles de cuisine anti- adhésion, les emballages alimentaires, les skis, les mousses anti-incendie, des vêtements pour la pluie, des fils électriques, des lubrifiants, etc. Pour l’industrie comme pour la consommation courante, ce sont des produits très utiles aux très nombreux usages.
Leur résistance à la dégradation rend inévitable l’exposition humaine aux PFAS « anciens » et alternatifs. L’exposition aux PFAS perturbe la fonction endocrinienne, y compris une perturbation de la thyroïde, affectant potentiellement le développement cognitif chez les femmes enceintes et les nouveau-nés. Métaboliquement, l’exposition aux PFAS est liée à la dyslipidémie[1]. Les impacts immunitaires sont liés à l’immunosuppression, à savoir une réponse insuffisante à la vaccination notamment chez les enfants. Certains PFAS ont des propriétés cancérigènes mais avec un niveau de preuve variable. Il faut noter que si la plupart des effets toxiques ont été décrits pour quelques PFAS anciens, il existe aussi des arguments en faveur de la toxicité des substituants plus récents. En revanche ces derniers semblent être moins persistants.
[1] Anomalie des concentrations de lipides dans le sang, souvent correspondant à une augmentation du cholestérol et/ou des triglycérides sanguins
LA MALÉDICTION DE LA PERSISTANCE
Un des problèmes majeurs des PFAS est leur persistance dans les organismes et dans l’environnement. Il est fréquent qu’on ne réalise la toxicité des composés chimiques qu’après leur commercialisation. Cela est dû aux limites des tests réglementaires qui ne couvrent pas l’ensemble des impacts possibles et qui sont par définition très rigides dans leurs méthodologies, ce qui d’ailleurs leur donne une robustesse et une répétabilité très bonne ; ces propriétés des tests réglementaires ne permettent pas de couvrir l’ensemble des cibles et de rechercher des effets en utilisant des approches hors des sentiers battus. En revanche la recherche académique permet ce type d’approche et il n’est pas rare qu’elle mette en évidence des impacts toxiques non retrouvés initialement. Étant donnés ces constats, il est clair que les substances persistantes soulèvent des questions particulières. En effet, si ces substances s’avèrent toxiques, il sera très difficile de les éliminer. On voit ainsi que malgré l’interdiction des PCB et du DDT, nous retrouvons toujours ces composés dans l’environnement et dans le sang humain. Il en sera de même des PFAS.
LA MALÉDICTION DE LA MOBILITÉ
En raison de leur caractère amphiphile, les PFAS sont aussi solubles dans l’eau. Lorsqu’ils contaminent les sols ils peuvent être transportés, contaminer les nappes phréatiques et les cours d’eau et se déplacer sur de longues distances par ce biais. Ce n’est pas le cas des substances purement hydrophobes comme les PCB et le DDT (qui sont plutôt transportés par les vents en raison de leur adhésion à des particules ou lorsqu’ils contaminent des poissons). Les agences européennes classent donc à part les substances très persistantes et très mobiles comme les PFAS.
LA MALÉDICTION DES GRANDS NOMBRES
Comme nous l’avons dit précédemment, on compte aujourd’hui 12 000 composés PFAS. Quelques dizaines sont plus particulièrement étudiés. Ces composés ont des chaînes latérales de tailles différentes et sans doute des propriétés de persistance différentes. Cependant, il est difficile de savoir si l’ensemble des PFAS vont avoir le même type de toxicité. À ce stade, il y a beaucoup de connaissances sur quelques PFAS et pratiquement rien sur des milliers d’autres. Il est inimaginable de faire pour les 12 000 PFAS les mêmes études que celles réalisées pour les quelques dizaines les plus connues ; par ailleurs, l’industrie dispose d’un grand panel de substituants si les PFAS actuellement utilisés sont interdits. Mais comment accélérer l’analyse de toxicité des PFAS avant qu’ils ne commencent à être utilisés comme substituants aux molécules interdites ? Il est inimaginable de refaire l’ensemble des études faites sur les plus connues. Deux possibilités se présentent : soit considérer que les PFAS font partie de la même classe et réglementer la classe entière (avec quelques exceptions justifiées) ; soit améliorer les connaissances sur les mécanismes de toxicité pour pouvoir développer des outils prédictifs (notamment numériques) capables d’analyser rapidement la toxicité potentielle d’une substance préconisée.
LES PARADOXES DES ÉTUDES RÉGLEMENTAIRES DE TOXICITÉ
Il existe des tests réglementaires pour détecter la toxicité des substances chimiques. Dans le domaine du risque cancéreux, ces tests peuvent comprendre des essais chez le rongeur qui durent deux ans. À la suite à ces tests, il arrive que le résultat soit positif. Or, on ne conclut pas nécessairement que la substance en question est cancérigène pour l’homme. En effet, si l’industriel arrive à montrer que la cancérogénicité chez l’animal (ou la toxicité de manière générale) est due à un mécanisme très spécifique du rongeur et qui ne se retrouve pas chez l’homme, alors on conclut que la cancérogénicité observée n’est pas pertinente pour l’homme. Il existe des cas très classiques allant dans ce sens. Par exemple, les fibrates sont des médicaments contre les excès de lipides dans le sang qui sont largement utilisés et pour lesquels il n’y a pas d’arguments de cancérogénicité chez l’homme. Or, ces substances entraînent en quelques semaines des cancers hépatiques chez le rongeur par un mécanisme connu faisant intervenir leur liaison à une protéine bien connue, le récepteur PPAR. On sait maintenant qu’il y a des différences qualitatives et quantitatives entre les récepteurs PPAR humain et murin. Or le PFOA et le PFOS se lient aussi à ce récepteur et on a pu observer dans les études initiales des effets cancérigènes chez les souris. On en avait conclu que ces effets n’étaient pas transposables à l’homme.
Cependant des études plus approfondies ont malgré tout fourni des arguments en faveur de la cancérogénicité de ces PFAS. Ainsi le Centre international de recherche sur le cancer (CIRC qui dépend de l’OMS) considère à présent le PFOA comme un cancérigène certain et le PFOS comme un cancérigène possible. Tout ceci nous conduit à remettre en question l’approche utilisée par les tests réglementaires et qui semblait a priori assez logique. Cette remise en question est justifiée par les arguments suivants : si une substance est cancérigène chez l’animal et que par ailleurs elle a un mécanisme d’action donné non conservé chez l’homme, il est absolument nécessaire de bien démontrer que ce mécanisme est bien responsable de la cancérogénicité
chez l’animal. En effet, certaines substances chimiques ont des mécanismes d’action multiples. Par ailleurs, dans le cas précis cité plus haut, même si les fibrates ne sont pas toxiques chez l’homme, il n’est pas possible de conclure que les PFAS qui activent le même récepteur ne le sont pas : en effet, les interactions de deux substances différentes avec un même récepteur peuvent être distinctes et conduire à des impacts différents. La leçon qu’on peut en tirer est qu’il est nécessaire de revoir le nombre, les conditions d’exécution et l’interprétation des essais réglementaires. C’est le bon moment puisqu’il y a une volonté citoyenne, politique et scientifique de faire évoluer ces tests en diminuant le plus possible l’utilisation des animaux.
SE MÉFIER DES SUBSTITUANTS
Comme nous l’avons dit plus haut, il existe des milliers de substituants possibles aux PFAS les plus connus. Certains de ces substituants ont initialement donné des résultats indiquant une moindre toxicité. Or des analyses plus approfondies indiquent que ces substances sont aussi toxiques. Ce constat nous conduit à reposer la question de la validité et de l’exhaustivité des tests réglementaires. Si l’utilité de ces tests ne doit pas être remise en question, en revanche le fait qu’ils aient échoué à prédire la toxicité de certaines substances interroge. On peut en particulier leur reprocher de ne pas s’approprier suffisamment vite les avancées de la science et de ne pas être exhaustifs. Il est en effet difficile de valider de nouveaux tests, ce qui peut se comprendre en raison de la nécessité de prouver leur robustesse et leur capacité à prédire des effets toxiques, mais des délais trop longs entre le développement de nouveaux tests et leur application pratique (environ une dizaine d’années, voire plus), ont des impacts négatifs en termes de santé publique. Il est donc nécessaire de simplifier et d’accélérer l’introduction de nouveaux tests dans la batterie de tests actuellement validés.
QUELQUES LEÇONS
Le cas des PFAS nous enseigne qu’il faut se méfier des substances persistantes, ce qui est d’ailleurs le cas à présent au niveau de l’agence européenne des produits chimiques (EChA). La mobilité de ces substances est une condition aggravante puisqu’elle favorise leur diffusion. Le point majeur est la nécessité d’accélérer le développement d’outils permettant de prédire la toxicité des substituants, surtout lorsqu’il y en a potentiellement des milliers. Une alliance entre épidémiologistes, toxicologues et spécialistes du numérique est cruciale pour avancer dans ce domaine et protéger les populations.
RÉFÉRENCES
Blake, B.E. and Fenton, S.E. (2020) Early life exposure to per- and polyfluoroalkyl substances (PFAS) and latent health outcomes: A review including the placenta as a target tissue and possible driver of peri- and postnatal effects. Toxicology 443, 152565.
Coperchini, F. et al. (2020) Thyroid Disrupting Effects of Old and New Generation PFAS. Front Endocrinol (Lausanne) 11, 612320.
Cordner, A. et al. (2021) The True Cost of PFAS and the Benefits of Acting Now. Environ Sci Technol 55, 9630–9633.
Kahn, L.G. et al. (2020) Endocrine-disrupting chemicals: implications for human health. Lancet Diabetes Endocrinol 8, 703–718.
Langenbach, B. and Wilson, M. (2021) Per- and Polyfluoroalkyl Substances (PFAS): Significance and Considerations within the Regulatory Framework of the USA. Int J Environ Res Public Health 18, 11142.
Liu, Y. et al. (2020) Exposure characteristics for congeners, isomers, and enantiomers ofperfluoroalkyl substances in mothers and infants. Environ Int 144, 106012.
Pérez, F. et al. (2013) Accumulation of perfluoroalkyl substances in human tissues. Environ Int 59, 354–362.
Zheng, G. et al. (2023) Elevated Levels of Ultrashort- and Short-Chain Perfluoroalkyl Acids in US Homes and People. Environ Sci Technol 57, 15782–15793.




